Raport de Cerectare Sintetic 2018
2.1. Construirea dispozitivului experimental și testarea lui / îmbunătățirea parametrilor săi tehnici. (Pachet de lucru WP1, continuare din 2017) (A3) În cadrul activității A1.3 din Etapa 1 s-a stabilit designul și dimensiunile celulei microfluidice și au fost prezentate schematic. CO împreună cu P1 au stabilit că fabricarea canalelor microfluidice din PMMA va deservi cu succes experimentelor cu bacterii Gram-pozitive și Gram-negative, fără a afecta viabilitatea acestora. Prezentarea schematică a dispozitivului experimental și a modului de realizare a experimentelor sunt evidențiate în Figura 1.
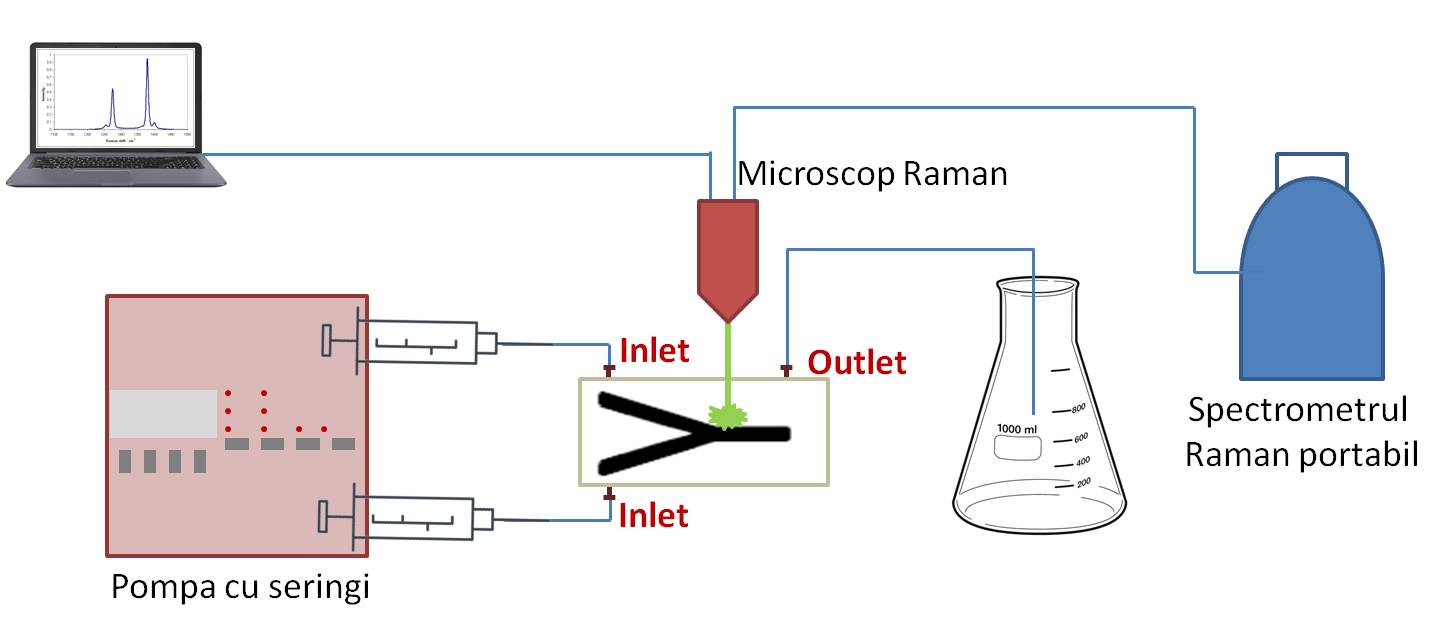 Figura 1. Schema dispozitivului experimental.
Figura 1. Schema dispozitivului experimental.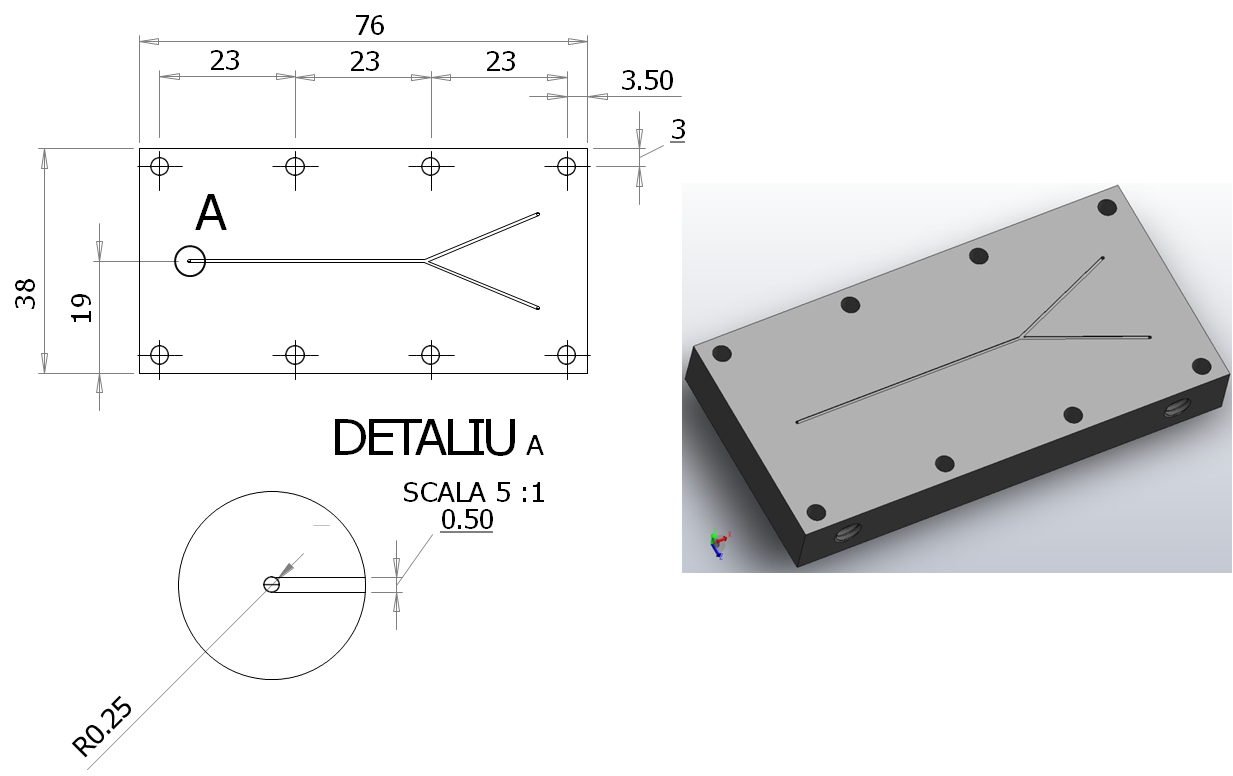 Figura 2. (a) Desen tehnic și reprezentarea 3D a celulei microfluidice. (b) Celula microfluidică.
Figura 2. (a) Desen tehnic și reprezentarea 3D a celulei microfluidice. (b) Celula microfluidică.
 Figura 3 prezintă sistemul microfluidic integrat în configurația experimentală.
Figura 3 prezintă sistemul microfluidic integrat în configurația experimentală.2.2. Testarea dispozitivului experimental și îmbunătățirea parametrilor săi tehnici (A3) 2.2.1 Sinteza spotului de argint În prepararea substratului amplificator SERS am folosit o pompă de injecție care permite injectarea simultană, cu același debit, a azotatul de argint (AgNO3) și citratul de sodiu (Na) (Figura 4), substratul fiind preparat în teriorul canalului din celula microfluidică.
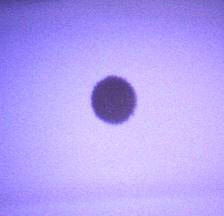
 Figura 4. Imagini de microscopie optică cu un spot de Ag (stânga) și trei spoturi de Ag suprapuse (dreapta).
Figura 4. Imagini de microscopie optică cu un spot de Ag (stânga) și trei spoturi de Ag suprapuse (dreapta). Figura 5. Topografia AFM obținută pentru spotul de Ag. (stanga) Imaginea 2D-AFM a spotului pe o suprafață de 10 μm × 10 μm; (dreapta) Imaginea 2D-AFM a spotului pe o suprafață de 2 μm × 2 μm;
Figura 5. Topografia AFM obținută pentru spotul de Ag. (stanga) Imaginea 2D-AFM a spotului pe o suprafață de 10 μm × 10 μm; (dreapta) Imaginea 2D-AFM a spotului pe o suprafață de 2 μm × 2 μm; 2.3. Optimizarea detecției SERS cu sistemul de curgere microfluidic nou dezvoltat, folosind microscopul Raman convențional (A3) Au fost analizate prin SERS două tipuri de bacterii: Escherichia coli (E. coli) – bacterie Gram-negativă și Streptoccocus aureus (S. aureus) – bacteria Gram-pozitivă. Pentru achiziționarea spectrelor SERS, s-a folosit un microscop Raman Renishaw InVia echipat cu un laser NdYAG cu frecvență dublată, ce emite la 532 nm și 785 nm. Radiația laser a fost focalizată pe probă utilizând un obiectiv Leica de 5× (NA = 0,12). Puterea laserului pe probă a fost de ~ 60 mW. Timpul de achiziționare a spectrelor a fost de 16 secunde, 4 achiziții de câte 4 secunde fiecare, atât cu linia laser 532 nm cât și cu 785 nm. 2.3.1. Măsurători SERS pe probe E. coli
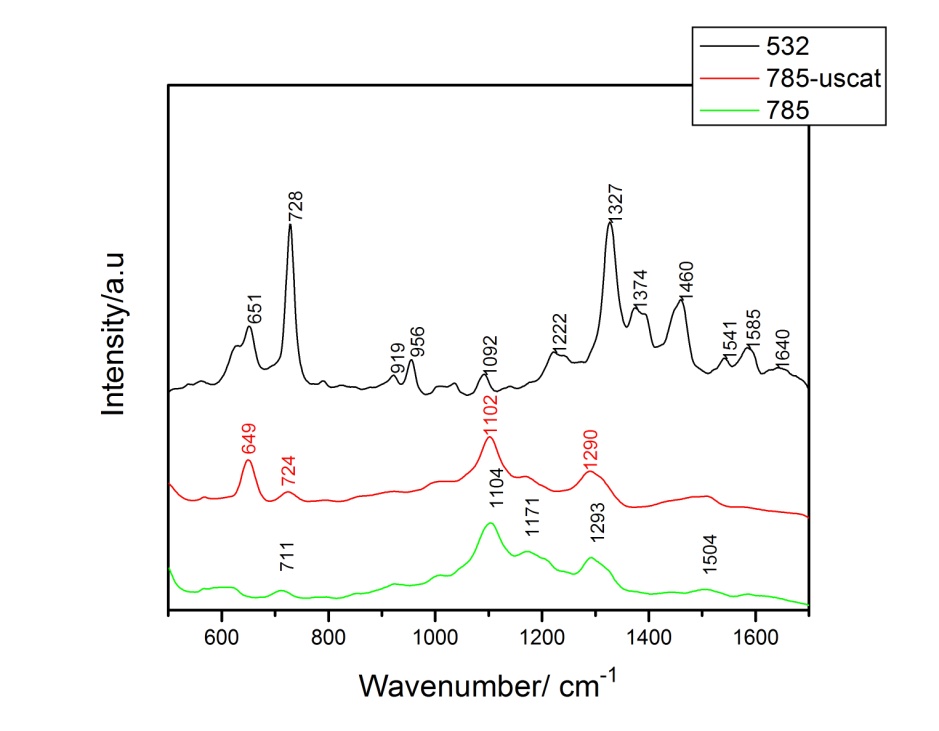 Figura 6. Spectrele SERS medii ale probelor E. coli, cu diferite linii laser.
Figura 6. Spectrele SERS medii ale probelor E. coli, cu diferite linii laser. 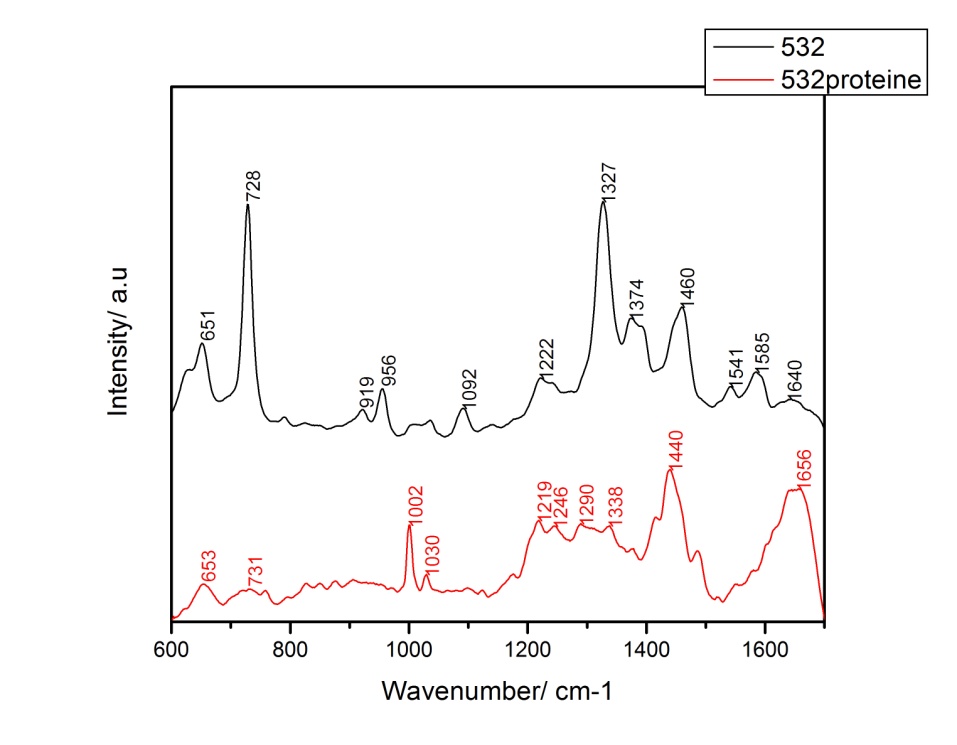 Figura 7. Spectrele SERS medii ale probelor de E. coli înainte (negru) și după adăugarea de KI (roșu).
Figura 7. Spectrele SERS medii ale probelor de E. coli înainte (negru) și după adăugarea de KI (roșu).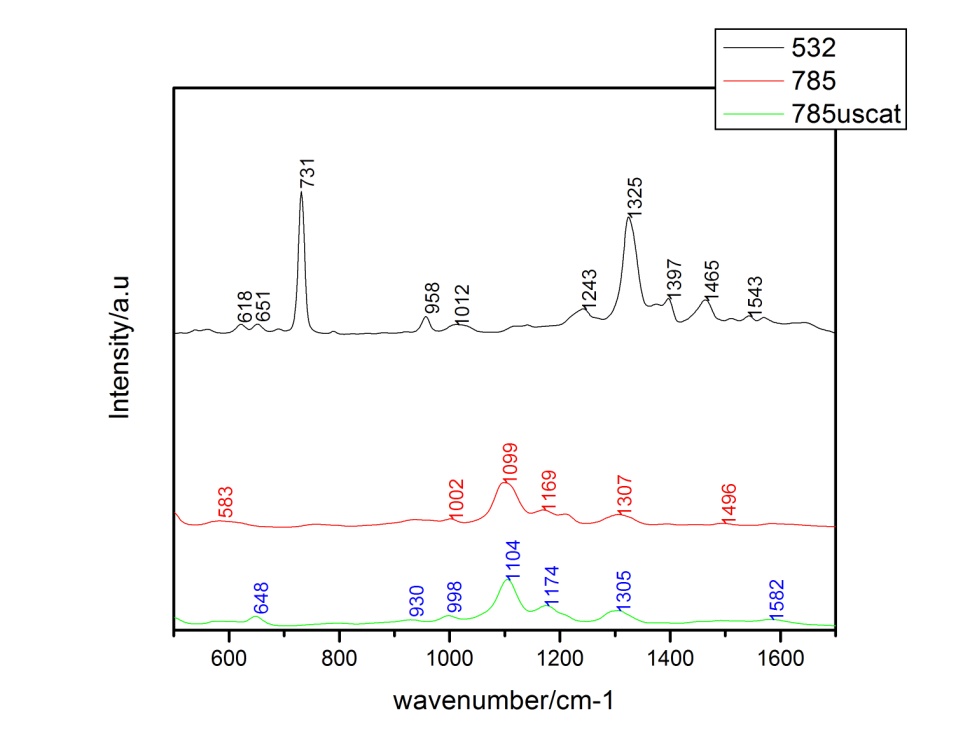 Figura 8. Spectrele SERS medii ale probelor S. aureus, cu diferite linii laser.
Figura 8. Spectrele SERS medii ale probelor S. aureus, cu diferite linii laser.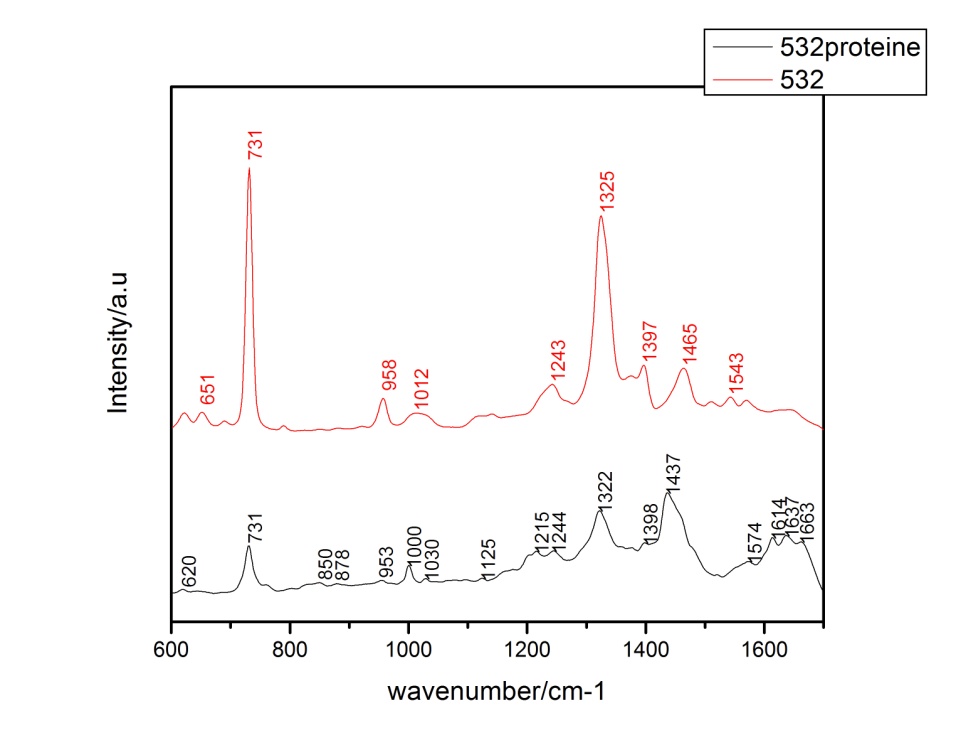 Figura 9. Spectrele SERS de la probele de bacterii S. aureus obținute cu nanoparticulele simple de citrat (roșu) și cu nanoparticulele de citrat modificate cu ioni de iod (negru).
Figura 9. Spectrele SERS de la probele de bacterii S. aureus obținute cu nanoparticulele simple de citrat (roșu) și cu nanoparticulele de citrat modificate cu ioni de iod (negru).2.4. Optimizarea detecției SERS a patogenilor folosind sistemului de curgere microfluidic nou dezvoltat și spectrometrul portabil (A3) În această activitate s-a testat dispozitivul dezvoltat, utilizând probe biologice și spectrometrul Raman portabil ca și instrument de detecție. S-a avut în vedere optimizarea vitezei de curgere în sistem și a timpului necesar detecției SERS în această configurație. 2.4.1. Condițiile de creștere ale bacteriilor: Activarea tulpinilor bacteriene, Realizarea dilutiilor seriale, Creșterea și pregătirea tulpinii pentru măsurători 2.4.2. Detecția SERS a bacteriilor Gram-negative și Gram-pozitive folosind sistemul de curgere microfluidic nou dezvoltat și spectrometrul portabil Pentru a demonstra eficacitatea ansamblului format din noul sistem microfluidic și spectrometrul Raman portabil, au fost testate două specii de bacterii Gram-negative (două tulpini de E. coli și P. aeruginosa) și trei specii de bacterii Gram-pozitive (S. aureus, E. faecalis și B. cereus). Parametrii experimentali pentru obținerea unor spectre SERS dominante de amprenta spectrală a microorganismelor au fost găsiți prin modificarea puterii laserului, ai timpilor de achiziție și a numărului de spectre SERS achiziționate și mediate. În final, măsurătorile SERS au fost efectuate folosind o putere a laserului la sursă de 20 mW, un obiectiv cu mărirea de 50× iar durata de acumulare a unui spectru a fost de 8 secunde cu o mediere a 3 spectre.
2.5. Înregistrarea spectrelor SERS cu scopul creării unei librării de spectre SERS și dezvoltarea unui model ACP (analiza prin componente principale) pentru o identificare precisă a patogenilor conținuți în baza de date.
2.6. Validarea metodologiei de detecție folosind probe intenționat contaminate (A3) Pentru a testa fiabilitatea metodei de detecție și discriminare bazată pe SERS-ACP, am sintetizat urină artificială după o rețetă propusă de Parra și colaboratori (Parra et al., 2016), pe care o considerăm potrivită deoarece este mult simplificată în comparație cu altele raportate în literatură. Astfel, vom avea mai puține ambiguități la interpretarea rezultatelor SERS. Rezultatele preliminare obținute prin SERS în urina artificială intenționat contaminate cu Bacillus cereus sunt prezentate în Figura 10. Benzile SERS ale derivaților de adenină (723 cm-1 și 1324 cm-1) sunt existente, dar în spectrul SERS al bacteriei spălate sunt foarte slabe sau inexistente. În comparație cu spectrul SERS al ureei (Figura 11), spectrul SERS a urinei artificiale contaminată cu B. cereus conține două benzi spectrale (la 1586 cm-1 și la 1044 cm-1) care pot avea contribuții atât de la uree cât și de la B. cereus.
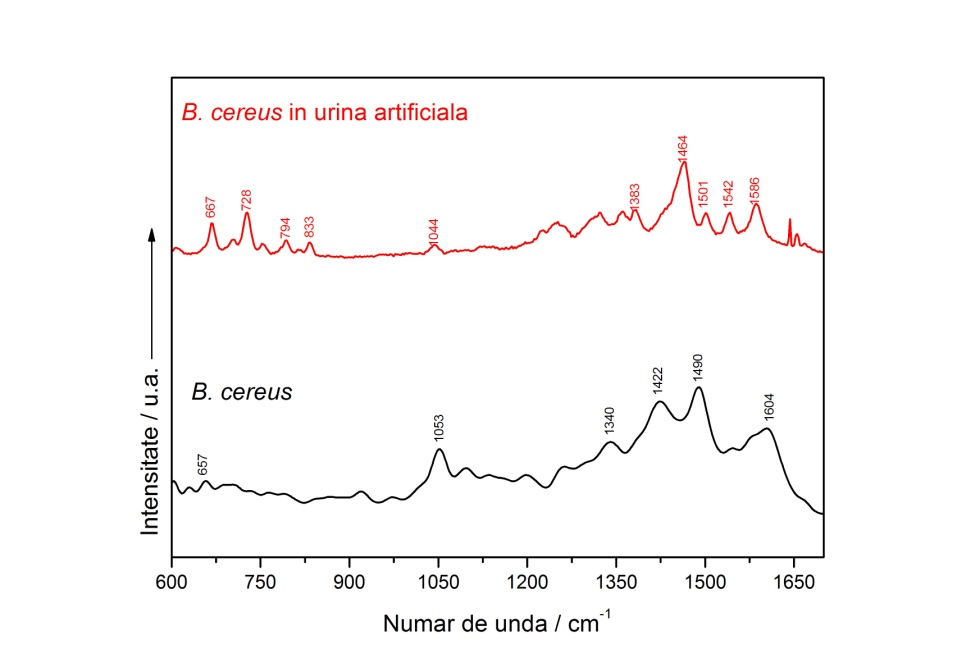 Figura 10. Spectrele SERS ale bacteriei B. cereus spălate (jos) și a probei de urină artificială contaminată cu B. cereus. (sus).
Figura 10. Spectrele SERS ale bacteriei B. cereus spălate (jos) și a probei de urină artificială contaminată cu B. cereus. (sus).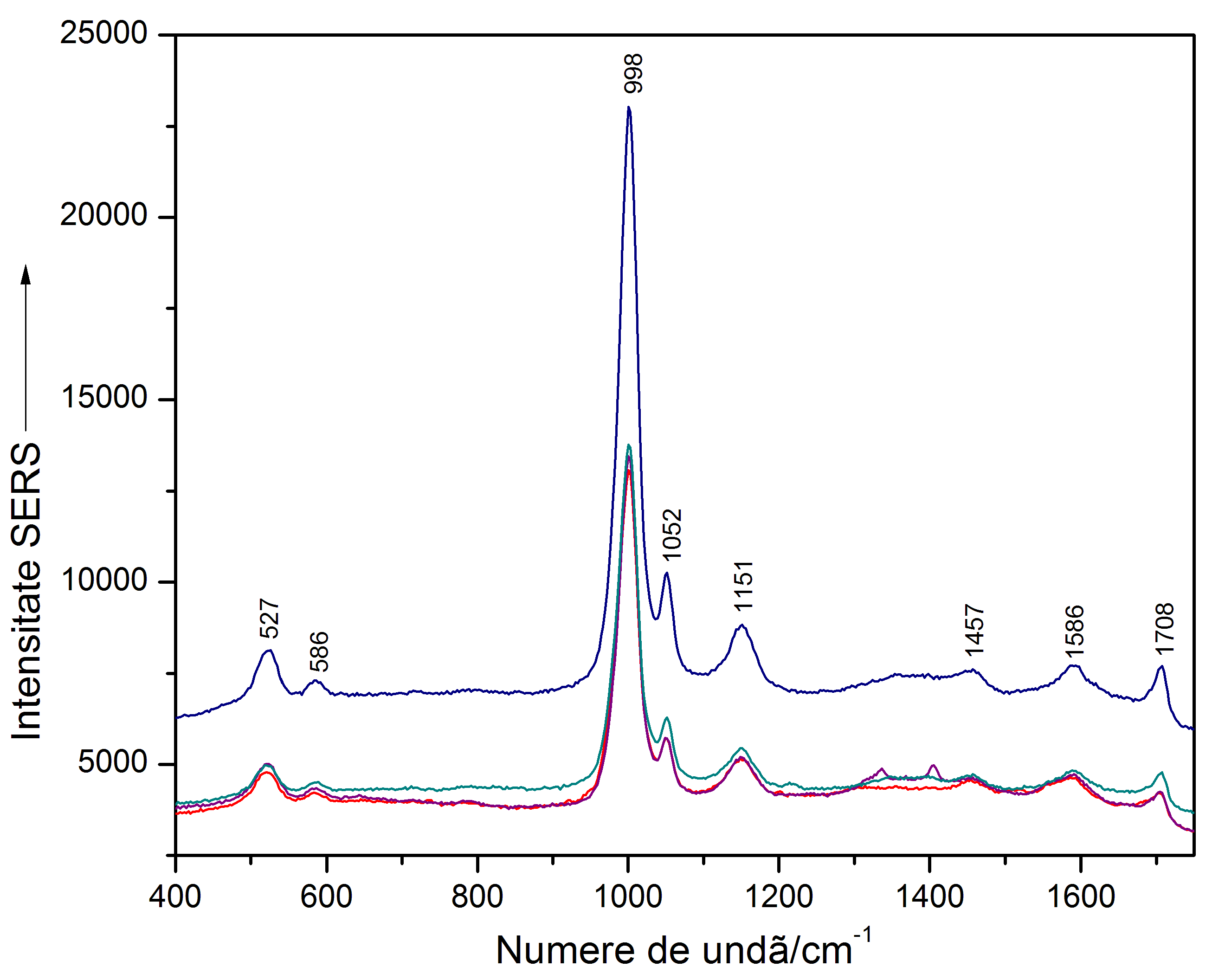 Figura 11. Spectre SERS ale ureei pure, în aceeași concentrație cu cea folosită în rețeta de urină artificial sintetizată.
Figura 11. Spectre SERS ale ureei pure, în aceeași concentrație cu cea folosită în rețeta de urină artificial sintetizată.În concluzie, până să putem implementa această tehnică de detecție pe bază de dispozitiv microfluidic pentru probe ce imită probele reale vor mai fi necesare câteva etape intermediare de optimizare a detecției ultrasenzitive cu această abordare.


